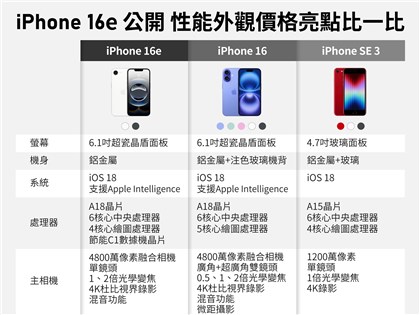
生華科膽管癌新藥 獲美FDA孤兒藥資格
(中央社記者韓婷婷台北4日電)生華生物科技今天宣布,CX-4945全新小分子抗癌藥已經取得美國食品藥物管理局(FDA),以膽管癌為適應症的孤兒藥資格認定(Orphan Drug Designation)。
美國FDA孤兒藥發展辦公室(Office of Orphan Products Development, OOPD)其實在去年12月22日,就已經正式發函通知生華美國子公司,CX-4945已經通過審查,取得膽管癌孤兒藥資格認定,但適逢美國聖誕節及新年連假,生華於今天才接獲正式通知信函。
CX-4945是一種全新的小分子藥物,在癌細胞DNA進行損傷修復的機制中,可抑制蛋白激酶CK2的活性,藉此阻斷癌細胞的自我修復能力,進而增強化療藥物毒殺癌細胞的效果,達到抗癌作用。CX-4945在晚期膽管癌的治療上,證明了它相當有利的安全性和藥效性。
膽管癌是一種罕見卻相當惡性的膽道癌症,在亞洲發病率是美國的十倍,但是早期發現不易,目前能有效治療的方式有限,5年平均存活率只有20%。
美國食品藥物管理局(FDA)對於罕見疾病具有診斷或治療展現潛力的藥物或檢測產品,給予孤兒藥的資格認定,以激勵藥物研發機構開發治療罕見疾病的藥物。在美國,罕見疾病的定義是病患數少於20萬名的疾病,經美國FDA認定為「孤兒藥」的藥品,可享有7年的獨賣權。
孤兒藥資格代表生華未來有機會透過較具彈性的審查制度申請藥品上市,加速CX-4945於膽管癌治療的發展。
生華生技總經理宋台生表示,CX-4945孤兒藥資格認定對生華在膽管癌治療的研發及法規策略是一項重要的里程碑。生華CX-4945在第一期臨床試驗中,對膽管癌病人是有臨床效益的,期待第二期臨床試驗的療效數據出爐。1060104
本網站之文字、圖片及影音,非經授權,不得轉載、公開播送或公開傳輸及利用。






![新創Figure機器人聽指令幫忙家務 朝居家應用邁進[影]](https://imgcdn.cna.com.tw/www/webphotos/WebCover/420/20250221/668x501_808252222919.jpg)








 請輸入正確的電子信箱格式
請輸入正確的電子信箱格式