高端疫苗技轉授權WHO 薛瑞元:國內產業受肯定
(中央社記者曾以寧、沈佩瑤台北30日電)高端COVID-19疫苗技轉授權世界衛生組織(WHO),創全球疫苗首例。衛生福利部長薛瑞元今天說,這表示國內疫苗產業受肯定。專家指出,將有助不適合打mRNA疫苗的族群。
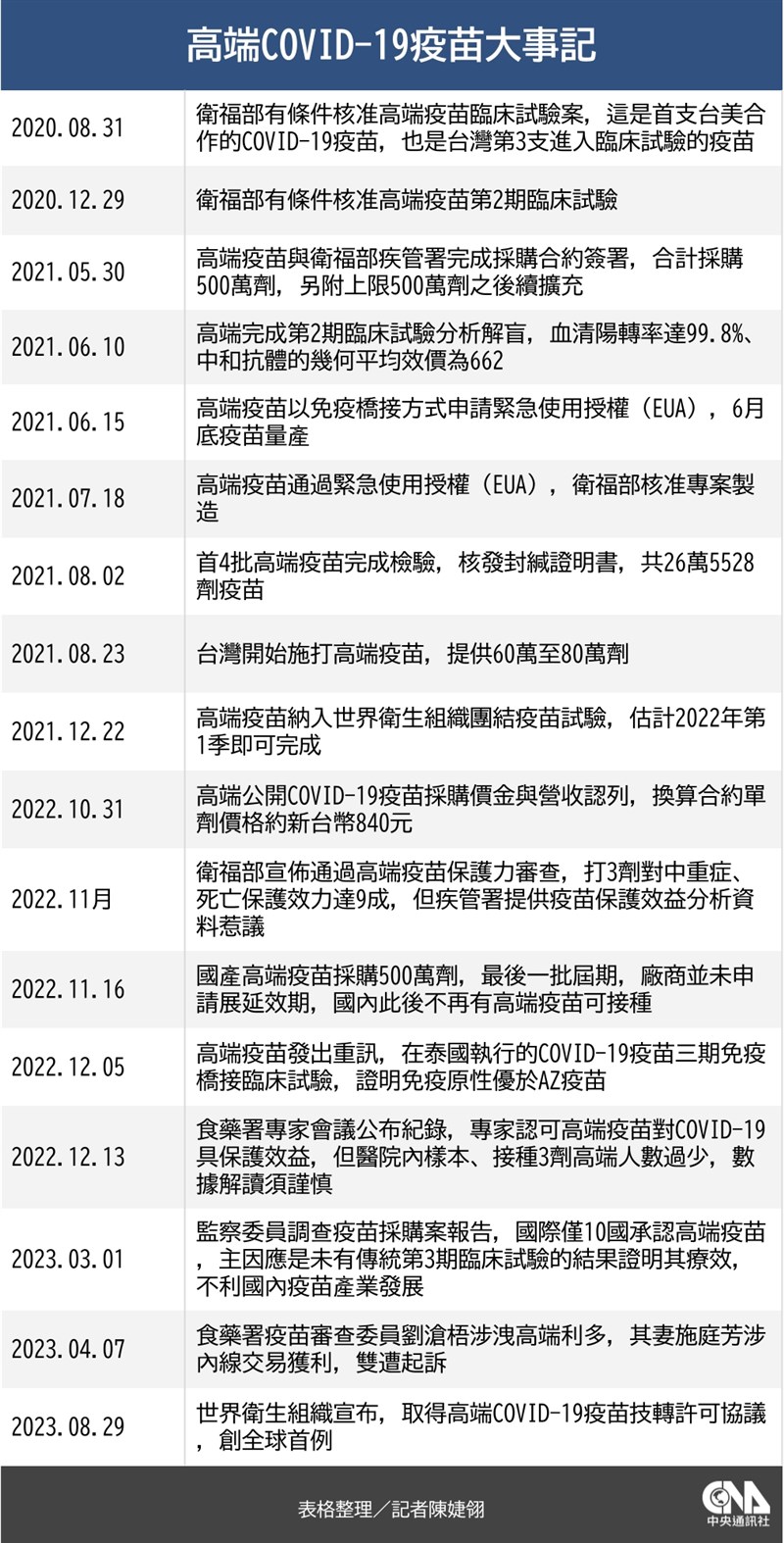
世界衛生組織(WHO)、藥品專利聯盟(MPP)與COVID-19技術獲取池(C-TAP)29日宣布,取得高端疫苗COVID-19(2019冠狀病毒疾病)疫苗技轉許可協議,創下全球疫苗首例。
薛瑞元今天接受媒體聯訪表示,要進入C-TAP,藥廠需要提出毒理試驗、動物試驗、臨床試驗等各樣數據,與工廠製程等資料供審查,據自己所知,相關送審資料與當初台灣食藥署在審核緊急使用授權(EUA)時所獲資料大致一致。
薛瑞元說,WHO審查後同意讓高端COVID-19疫苗進入C-TAP,創下全球首例,表示接受高端疫苗的審查資料,也表示國內疫苗製造產業與這次COVID-19疫苗經驗受到肯定。
衛福部傳染病防治諮詢會預防接種組(ACIP)召集人李秉穎接受媒體電訪說,世衛技術合作計畫最大目的是保護弱勢國家,獲得技術生產更便宜的疫苗以保護民眾;目前高端疫苗團結試驗報告最終結果尚未出爐,但會被世衛接受,一定是經過專家審查,認為製造過程、技術成熟可靠,「這是個肯定」。
對於相關爭議,李秉穎指出,懂疫苗學的人都知道高端疫苗是很好的疫苗,不良反應發生率比起mRNA或腺病毒疫苗都要低很多;此外,WHO認證的COVID-19疫苗,不少也是用免疫橋接、沒有經過第3期試驗,且緊急情況必須要變通,「這是國際通用準則,只是國內有些反對聲音,故意借題發揮」。
媒體追問,以國家經費去支持高端研發疫苗,卻將技術授權出去是否有疑慮。李秉穎說,投資國內產業、藉疫苗產業獲得WHO認可,是值得政府去做的事,國內產業能夠被WHO認證,對政府來講也是正面成果。
長庚大學新興病毒感染研究中心教授施信如告訴中央社記者,高端COVID-19疫苗技轉授權給WHO,表示未來將可以由別的國家、別的廠商利用此技術,繼續針對現在主流的新變異株研發蛋白質疫苗,供比較弱勢、有需要的國家使用。
施信如說明,目前國際上有針對新變異株製作疫苗的廠商為莫德納和BNT,兩者都是製作mRNA疫苗,但是針對無法接種mRNA疫苗、先前接種時已經出現嚴重不良反應的民眾,還是需要接種疫苗,因此轉出技術讓其他地方有機會繼續研發生產,「是一件好事」。
不過施信如也說,對於高端疫苗沒有進行第3期試驗,「還是覺得相當可惜」,不僅引起各樣爭議,也造成後續推向國際受到阻礙,只能在國內使用;當時若有在其他地區進行第3期試驗,這支疫苗可能會有不同發展。(編輯:管中維)1120830
- 2024/08/12 17:30
- 2023/09/07 10:40
- 2023/08/30 20:38
- 高端疫苗技轉授權WHO 薛瑞元:國內產業受肯定2023/08/30 18:35
- 2023/08/30 12:45
- 2023/08/30 09:42
本網站之文字、圖片及影音,非經授權,不得轉載、公開播送或公開傳輸及利用。
















 請輸入正確的電子信箱格式
請輸入正確的電子信箱格式



