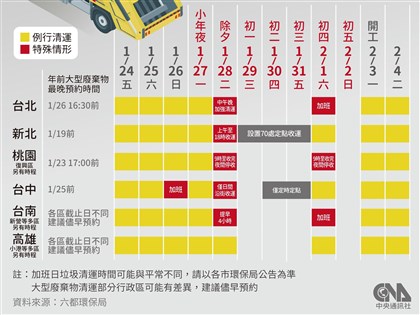
泰福獲美FDA上市許可 和迅首次技術授權
(中央社記者何秀玲台北1日電)大股東為潤泰集團、泰福-KY今天公告,接獲美國FDA(食品暨藥物管理局)核准旗下生物相似藥物TX01上市許可,為公司重大里程碑,將進軍美國生物相似藥市場。
泰福的生物相似藥TX01,原廠參考藥物為Neupogen(filgrastim),這是美國FDA所核發的filgrastim生物相似藥第4張上市許可。
泰福今天表示,獲得FDA的上市許可,為公司重大里程碑,有了美國FDA上市許可,代表泰福成為全方位的生物製藥公司。
泰福提到,除了自主研發生物相似藥之外,現在也開始提供生物藥品的委託開發暨製造的CDMO(委託開發暨生產服務)。從細胞株開發到產品通過FDA檢驗,進而取得BLA(生物藥品許可申請),現在更通過以審查嚴格聞名的美國FDA檢驗,再加上擁有位於美國本土的cGMP廠,公司已準備好在產品商業化及CDMO業務,盼全面進擊。
再生醫療公司和迅今天發出新聞稿宣布,攜手集研生醫簽訂「間質幹細胞藥物-生產技術」授權契約,其合約金總額可達600萬美元(約新台幣1.94億元),此為和迅首次技術授權。
第一階段和迅可收取180萬美元(約新台幣5843.79萬元)簽約金,後續分階段條件與開發進度達成,和迅各階段可收取授權金合計420萬美元(約新台幣1.36億元)。
和迅將提供臍帶間質幹細胞培養技術與外泌體生產技術給集研生醫,雙方共同合作開發由臍帶間質幹細胞衍生的外泌體,由集研生醫用於醫材、新藥、保養品等各式產品開發,所開發的產品可應用於傷口癒合治療與醫美應用領域。
和迅表示,除了CDMO和CMO業務已臻成熟之外,所發展的外泌體技術也達可授權階段,配合外泌體需求的市場成長,將持續為和迅營運注入成長動能。(編輯:張均懋)1130701
本網站之文字、圖片及影音,非經授權,不得轉載、公開播送或公開傳輸及利用。















 請輸入正確的電子信箱格式
請輸入正確的電子信箱格式