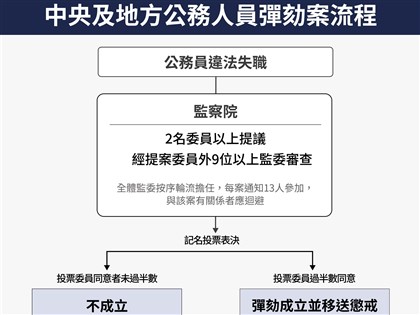
中國武漢肺炎疫苗進入上市審理 1月可望問世
(中央社台北24日電)雖然中國武漢肺炎疫苗臨床試驗數據一直都不透明,但絲毫未影響疫苗上市與接種時程。中國國家藥監局資料顯示,已受理中國國藥集團疫苗上市申請。陸媒稱,最快明年1月初就能附條件上市。
綜合香港經濟日報、陸媒第一財經、界面新聞報導,中國國家藥品監督管理局藥審中心,公告了中國國藥集團的2019冠狀病毒疾病(COVID-19,武漢肺炎)疫苗上市申請的受理號,換句話說,距離上市又更進一步。
報導指出,由於中國研發的武漢肺炎疫苗可望適用藥品「特殊審批」流程,因此審查流程可望大幅縮短。
報導引述一名中國製藥業界的相關人士分析,中國一般的藥物審批流程是60天,不過國家藥監局在12月21 日公布 「生物製品批簽發管理辦法」,當中明定,為了「預防、控制傳染病疫情或應對突發事件急需的疫苗,經國家藥品監督管理局批准,免予批簽發」。
報導提到,過去中國的藥物審批已存在「優先審批」的機制,對於有迫切需求、具公共性的藥物在經申請後可依這樣的管道進行。例如2018年4月20日,美商默沙東藥廠提出的九價人類乳突病毒(HPV)疫苗,就是使用優先審批措施,在8天內拿到上市許可。
報導指出,「特殊審批」的速度可望比「優先審批」更快,國藥研發的疫苗最快或許在明年1月初就能附條件上市。
雖然中國看似在這次的全球疫苗競賽中取得領先,但是外界質疑的聲浪從未停過,包含中國疫苗試驗數據至今未公布、臨床試驗剛展開就投入緊急使用的安全性疑慮、是否有合規追蹤並觀察接種情況的程序。
報導指出,日前美國食品藥品監督管理局(FDA)對輝瑞的武漢肺炎疫苗進行專家審查時,公開在網路上直播,並把資料向公眾展示,這種透明度為公眾帶來了信任和信心。
報導引述一名藥企負責人的說法指,「審批流程必須公開透明並以科學為基礎,希望也能看到中國新冠疫苗完全的研發試驗數據。」(編輯:吳柏緯/繆宗翰)1091224
本網站之文字、圖片及影音,非經授權,不得轉載、公開播送或公開傳輸及利用。